CRISPR诱导成纤维细胞重编程为心血管祖细胞并应用于心肌梗死治疗
导读
心血管祖细胞(cardiovasuclar progenitor cells, CPCs)具有自我更新的潜能,并在特定环境中同时生成血管和心肌细胞,在心脏再生医学领域具有重要意义和研究价值。尽管心脏中是否存在CPCs具有很大的争议,CPCs可以通过细胞重编程(直接改变细胞命系)的方法获得,例如诱导成纤维细胞。1-3细胞重编程技术有多个优势:1)使用体细胞(如皮肤成纤维细胞)作为起始细胞,可用非侵入方式取材,安全便捷;2)绕开多能性诱导,避免未成熟细胞形成畸胎瘤的风险;3)适用于细胞大规模生产并为心血管病干细胞治疗提高丰富细胞来源。然而,目前该技术发展至临床应用尚有较大距离,需要进一步完善细胞重编程诱导方法和机制研究,以产生功能稳定且表征明确的CPCs。
美国辛辛那提大学王义刚教授团队与易瑞达生物合作,运通过利用CRISPRa技术将成年小鼠的尾尖皮肤成纤维细胞转化为功能性的CPCs,并证明其对心肌梗死具有明显的修复作用。该研究成果在2022年1月发表于Molecular Therapy(IF 12.910)杂志。
研究结论
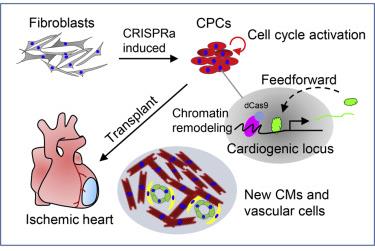
内源性基因的激活被认为是高质量完全重编程细胞的重要标准。6王教授研究发现,CRISPRa系统直接激活成纤维细胞的内源性基因座(例如Gata4, Nkx2.5和Tbx5等),并可以快速建立心脏转录因子激活网络,实现向CPC转化的重编程。其细胞重编程效率高达80%,这些细胞产品具有较高的增值活性并可在特定条件下产生功能性心肌细胞和血管细胞。此外,转录组测序揭示了细胞周期和心脏发育途径在早期重编程阶段对加速CPC形成具有非常重要作用。进一步的机制研究发现,CRISPRa系统打开了成纤维细胞沉默的心脏基因座的染色质,从而诱导转录因子激活自我的启动子,最终形成基因表达调控的正反馈环。诱导细胞在心脏球体形成前后的转录组学特征。最后,重编程的CPC移植到小鼠梗死的心肌组织中数天后产生新的心肌细胞和血管细胞,并降低心肌纤维化发生和显著改善缺血心肌的收缩功能。总之,CRISPRa诱导的多重基因激活可促使成纤维细胞向CPC转化,为心脏再生疗法提供了一种新的细胞来源。
参考文献:
1. van Berlo, J.H. & Molkentin, J.D. Most of the Dust Has Settled: cKit+ Progenitor Cells Are an Irrelevant Source of Cardiac Myocytes In Vivo. Circ Res 118, 17-19 (2016).
2. Zhang, Y. et al. Expandable Cardiovascular Progenitor Cells Reprogrammed from Fibroblasts. Cell Stem Cell 18, 368-381 (2016).
3. Lalit, P.A. et al. Lineage Reprogramming of Fibroblasts into Proliferative Induced Cardiac Progenitor Cells by Defined Factors. Cell Stem Cell 18, 354-367 (2016).
4. Willyard, C. The epigenome editors: How tools such as CRISPR offer new details about epigenetics. Nat Med 23, 900-903 (2017).
5. Wang, J. et al. Lineage reprogramming of fibroblasts into induced cardiac progenitor cells by CRISPR/Cas9-based transcriptional activators. Acta pharmaceutica Sinica. B 10, 313-326 (2020).
6. Smith, Z.D., Sindhu, C. & Meissner, A. Molecular features of cellular reprogramming and development. Nat Rev Mol Cell Biol 17, 139-154 (2016).



